Axit sunfuric một hợp chất hóa học đã quá đỗi quen thuộc với những ai đam mê hóa học. Không những vậy, nó còn được ứng dụng vào rất nhiều trong đời sống, nhất là trong những ngành công nghiệp sản xuất. Vậy axit sunfuric là gì? Chúng có những tính chất ra sao? Và được ứng dụng như thế nào trong đời sống. Hãy cùng VIETCHEM đi giải đáp những thắc mắc về hợp chất hóa học này qua bài viết sau đây nhé!
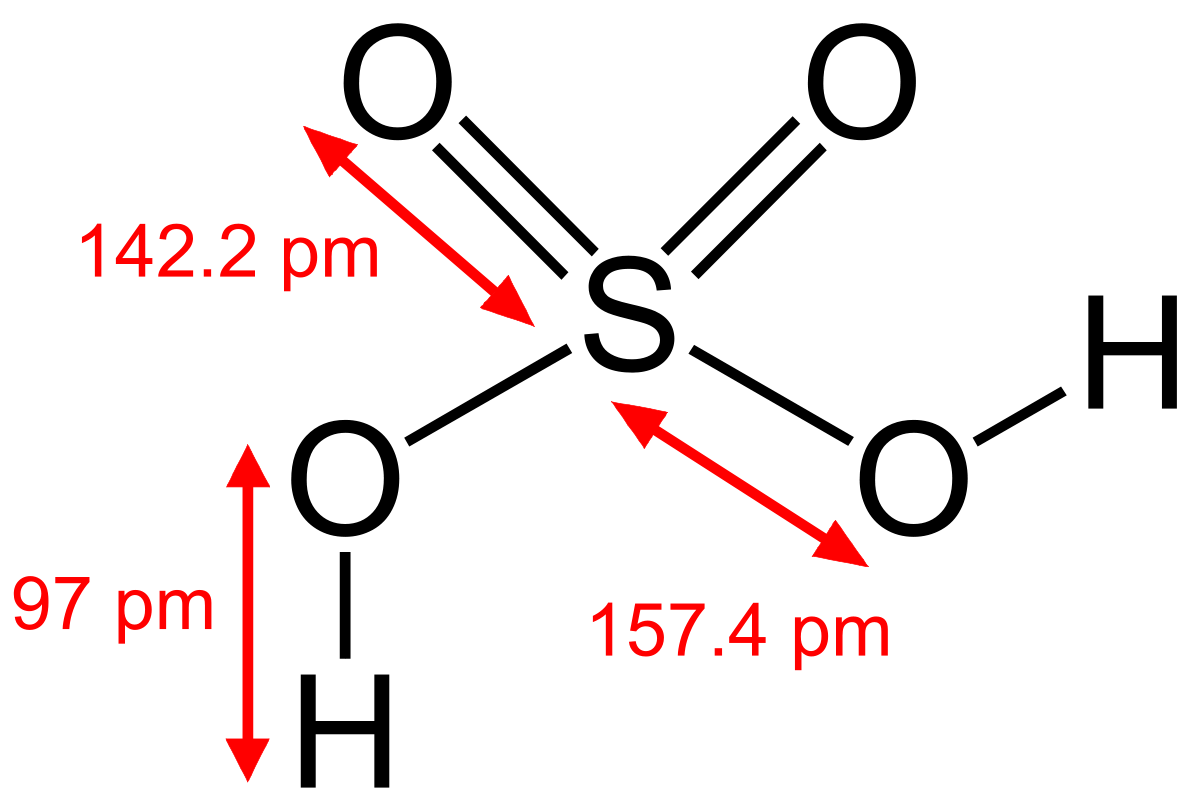
Cấu trúc phân tử axit phân tử H2SO4
I. Axit sunfuric là gì?
Axit sunfuric là một axit vô cơ gồm các nguyên tố lưu huỳnh, oxy và hydro với công thức hóa học là H2SO4. Axit sunfuric là hóa chất lỏng không màu, không mùi và sánh, hòa tan trong nước và một phản ứng tỏa nhiệt cao.
1. Cấu tạo phân tử H2SO4
-
Công thức phân tử là: H2SO4.
-
Công thức cấu tạo của H2SO4:
- Mô hình phân tử H2SO4 như sau:
Mô hình phân tử H2SO4
2. Tính chất vật lý của axit sunfuric H2SO4
- Axit sunfuric là chất lỏng, hơi nhớt và nặng hơn nước, khó bay hơi và tan vô hạn trong nước.
- Axit sunfuric đặc thường hút mạnh nước và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại, vì H2SO4 có thể gây bỏng.
- Axit sunfuric còn có khả năng làm than hóa các hợp chất hữu cơ.
Mua hóa chất Axit Sunfuric H2SO4 95% tại đây
3. Tính chất hóa học của axit sunfuric H2SO4
a, Axit sunfuric loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
b, Axit sunfuric đặc
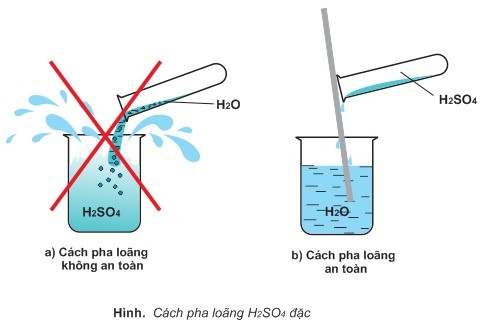
Cách pha loãng H2SO4
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Axit sunfuric đặc, nóng tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau H như Cu, Ag)…”
Cu + 2H2SO4(đặc nóng) → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
4. Điều chế axit sunfuric (H2SO4)
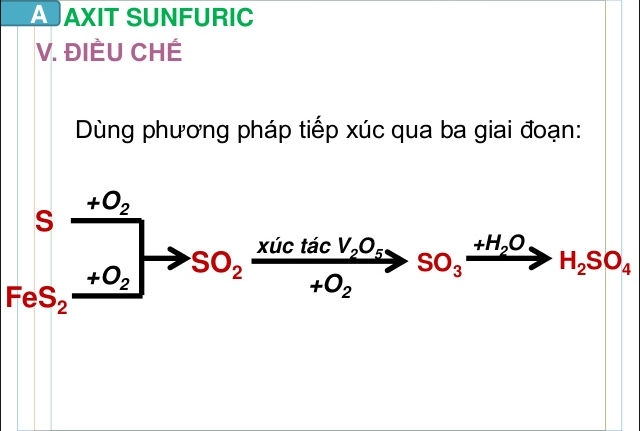
Cách điều chế axit sulfuric
Thông thường H2SO4 được sản xuất bằng cách đốt cháy quặng firit sắt, oxi hóa SO2 bằng oxi trong điều kiện 400 – 500 độ C, pha loãng hóa chất oleum thành axit sunfuric bằng lượng nước thích hợp…
5. Các dạng của axit sunfuric H2SO4
Mặc dù có thể sản xuất axit sunfuric 100%, nhưng nó sẽ mất SO3 ở điểm sôi để tạo ra axit 98,3%. Các nồng độ khác nhau của axit sunfuric được sử dụng với những mục đích khác nhau có thể kể đến như:
- Axit sunfuric loãng nồng độ 10 % thường được dùng trong phòng thí nghiệm.
- H2SO4 nồng độ 33,5% được dùng cho ắc quy.
- Axit sunfuric được dùng để sản xuất phân bón có nồng độ 62,18%.
- Axit sunfuric nồng độ 77,67% được dùng trong tháp sản xuất hay axit glover.
- Nồng độ 98% là axit ở dạng đậm đặc.
6. Tính dẫn điện và tính phân cực của H2SO4
Axit sunfuric khan là một chất lỏng phân cực, hằng số điện môi khoảng 100. Điều này là do nó có thể phân ly bằng cách tự proton hóa chính nó, là một quá trình được biết đến là tự proton hóa.
Phương trình thể hiện:
2 H2SO4 → H3SO4+ + HSO4−
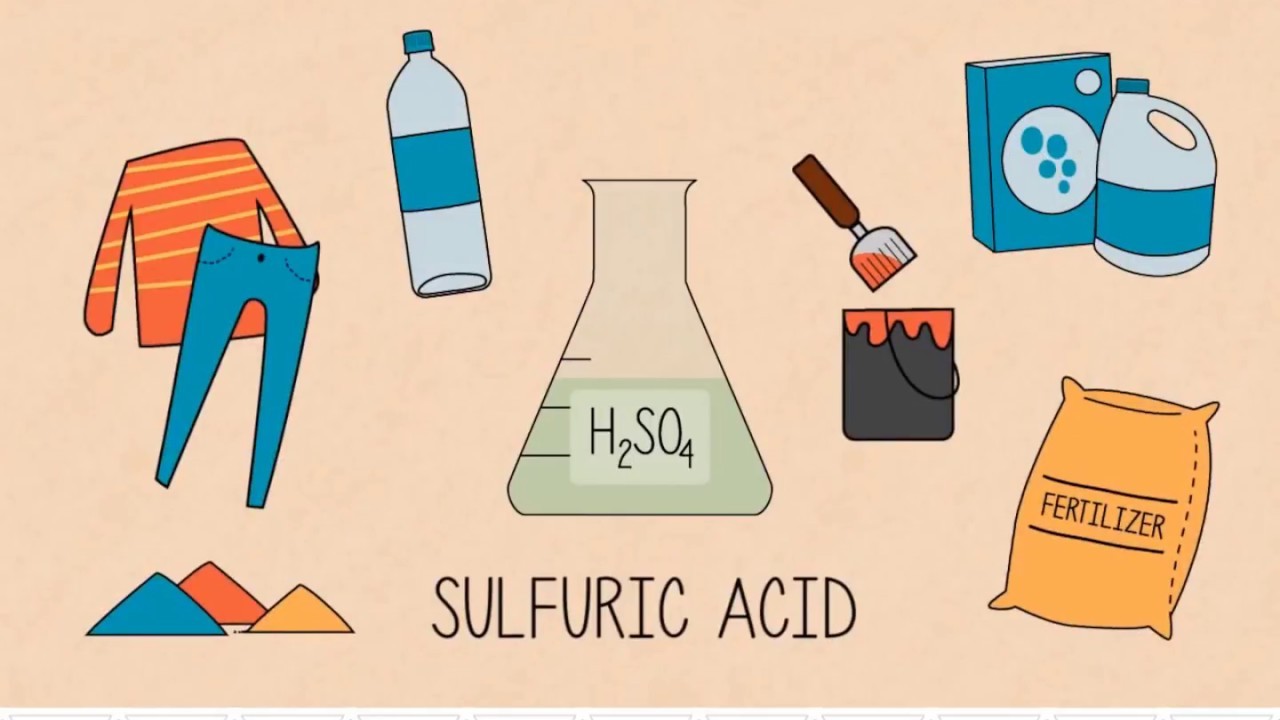
II. Ứng dụng của hóa chất axit sunfuric H2SO4 trong đời sống
Axit sunfuric là một trong những hóa chất được sử dụng hàng đầu trong công nghiệp với vai trò nguyên liệu chính hay chất xúc tác. Loại hóa chất này được dùng nhiều nhất trong các ngành sản xuất phân bón, sản xuất tơ sợi hóa học, chất dẻo, chất tẩy rửa, sơn màu,…
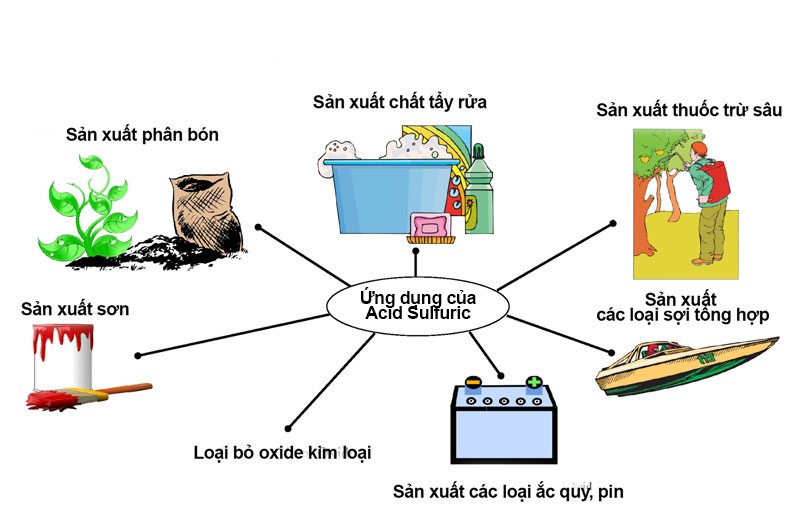
Ứng dụng của axit sunfuric
1. Trong sản xuất phân bón
Axit sunfuric được dùng chính trong để sản xuất axit photphoric, một nguyên liệu không thể thiếu để sản xuất các loại phân photphat. Và nó cũng được dùng để sản xuất Amoni sunfat.
2. Trong sản xuất công nghiệp
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,… và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ.
Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các dạng ắc quy, axit chì,…
Mỗi năm có khoảng 160 triệu tấn H2SO4 được sử dụng, nổ bật trong các ngành sản xuất như phân bón 30%, chất tẩy rửa 14%, giấy, sợi 8%, chất dẻo 5%, luyện kim 2%, phẩm nhuộm 2%, …
3. Trong xử lý nước thải
Axit sunfuric được sử dụng để sản xuất nhôm hidroxit, chất được dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ các Ca2+, Mg2+, có trong nước thải.
Lưu ý: Về tác hại của axit sunfuric, đây là hóa chất nguy hiểm, hạng một ăn mòn và gây bỏng rộp da. Vì thế khi sử dụng nên trang bị đầy đủ các dụng cụ chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khio pha chế…

Axit sunfuric được dùng trong quy tình xử lý nước thải công nghiệp
4. Trong phòng thí nghiệm
Axit sunfuric là hợp chất đậm đặc dùng để điều chế các axít khác yếu hơn: HNO3, HCl ở trong thí nghiệm.
Là hóa chất không thể thiếu trong các phản ứng để đưa ra những kết quả, ứng dụng vào trong các lĩnh vực khác của cuộc sống.
III. Những lưu ý khi sử dụng và cách bảo quản H2SO4
1. Những lưu ý khi sử dụng H2SO4
Khi sử dụng cần phải pha loãng axit sufuric với nước, sau đó cho từ từ axit vào nước rồi sau đó khuấy đều, tuyệt đối không được làm ngược lại. Cần sử dụng găng tay và kính khi tiếp xúc với H2SO4 loãng, và khi tiếp xúc với axit đậm đặc thì cần phải có các tấm bảo vệ mặt và tạp dề PVC để đảm bảo an toàn nhất.
2. Lưu ý khi bảo quản
Vì là một axit rất mạnh, nên chúng cần được bảo quản tránh xa bazơ và các chất khử. Đối với Axit Sunfuric loãng, không được đựng trong bình sắt, nhôm. Tuy nhiên, Axit Sunfuric đặc, nguội có hiện tượng thụ động hóa với sắt và nhôm, nên có thể vận chuyển bằng bồn thép chuyên dụng.
3. CẢNH BÁO NGUY HIỂM
H2SO4 là chất ăn mòn cực mạnh, gây bỏng sâu và hoại tử ngay lập tức khi tiếp xúc.
- Nếu dính vào da: Lập tức rửa dưới vòi nước sạch chảy liên tục ít nhất 15-20 phút. Không được chà xát mạnh. Cởi bỏ quần áo dính hóa chất cẩn thận. Đưa nạn nhân đến cơ sở y tế.
- Nếu bắn vào mắt: Rửa mắt bằng nước sạch hoặc dung dịch rửa mắt khẩn cấp liên tục trong ít nhất 20-30 phút, giữ mí mắt mở. Đến ngay bác sĩ nhãn khoa.
- Nếu hít phải: Đưa nạn nhân ra nơi thoáng khí, giữ ấm và để nghỉ ngơi. Nếu khó thở, cần hỗ trợ hô hấp y tế.
Nếu nuốt phải: KHÔNG được gây nôn. Cho nạn nhân súc miệng bằng nước (nếu còn tỉnh táo). Gọi cấp cứu ngay lập tức.
IV. Lựa chọn mua hóa chất sunfuric chất lượng tại đâu?
Nên mua axit sunfuric ở đâu?
Chắc hẳn đây là câu hỏi đặt ra của rất nhiều người đang tìm địa chỉ bán hóa chất axit sunfuric chất lượng, vậy thì hãy lựa chọn mua axit sunfuric tại VIETCHEM- một trong những địa chỉ tin cậy chuyên cung cấp các loại hóa chất công nghiệp, hóa chất tinh khiết uy tín. Trong đó, các hóa chất axit sunfuric được ứng dụng rộng rãi trong để trung hòa pH trong xử lí nước thải, sử dụng để loại bỏ các ion Mg2+, Ca2+ có trong nước thải và được sử dụng trong sản xuất phân bón, chế biến quặng, tổng hợp hóa học, tinh chế dầu mỏ…
Đây là địa chỉ bán axit sunfuric giá tốt nhất trên thị trường. Không những vậy, khách hàng còn nhận được sự tư vấn tận tình, dịch vụ giao hàng nhanh chóng chuyên nghiệp, hàng hóa đến tay khách hàng nhanh nhất có thể.
Không chỉ có hóa chất xử lý nước, VIETCHEM còn phân phối các loại hóa chất công nghiệp khác như:
- Dung môi công nghiệp.
- Hóa chất sản xuất điện tử.
- Hóa chất khai khoáng.
- Hóa chất nhiệt điện.
- Hóa chất trong công nghiệp thực phẩm.
- Hóa chất ngành xi mạ.
- Hóa chất ngành dệt nhuộm.
- Hóa chất bảo trì.
Hy vọng rằng, bài viết trên giúp mọi người hiểu rõ hơn về đặc điểm, tính chất, ứng dụng và địa chỉ bán axit sunfuric chất lượng tốt nhất. Liên hệ ngay cho VIETCHEM tại HOTLINE 0826 010 010 hoặc truy cập TẠI ĐÂY để được tư vấn, báo giá và đặt hàng nhanh nhất nhé!
Xem thêm: TỶ TRỌNG KẾ ĐO NỒNG ĐỘ AXIT H2SO4 TRONG BÌNH ACQUY

