Đối với chương trình hóa học THCS và THPT (từ lớp 8 đến lớp 12), các em học sịnh sẽ được học cả hóa vô cơ và kiến thức chuyên sâu về hóa hữu cơ. Vì vậy, rất nhiều lý thuyết và công thức cần nhớ. Tài liệu học tập sẽ giúp các em ôn tập và nắm vững các công thức hóa học quan trọng xuyên suốt THCS và THPT trong bài viết dưới đây. Bài viết sẽ tổng hợp lại những công thức hóa học lớp 8,9,10 cốt lõi và các công thức của hóa hữu cơ từ lớp 10 đến lớp 12 quan trọng một cách chi tiết dễ nhớ nhất.

Cần hiểu công thức hóa học là gì?

Công thức hoá học là công thức được dùng để biểu diễn thông tin về các nguyên tố có trong hợp chất hoá học, đồng thời để diễn tả về quá trình phản ứng xảy ra. Mỗi một công thức được xây dựng mang tính đặc thù riêng, chỉ mô phỏng những tính chất của một hợp chất, diễn đạt những tính chất đặc thù của hợp chất hay phản ứng đó.
Trong hoá học, ngoài các công thức hoá học của chất và hợp chất, còn sử dụng một số công thức căn bản như tính số mol, nồng độ tan, tính hóa trị,… để tính toán và giải quyết các bài toán trong hoá học.
Những công thức hóa học lớp 8, 9 cần nhớ
Trước khi tiến vào chương trình hoá học 10, các em học sinh cần hiểu rõ và nắm được những tính chất cơ bản của hoá học cấp THCS (cụ thể là kiến thức hoá học 8 và 9). Đây chính là tiền đề để các em học tập và phát triển kiến thức về các công thức hoá học lớp 10.
Dưới đây là tổng hợp công thức hoá học lớp 8 và lớp 9 mà các em cần ghi nhớ:

Công thức tính số mol:
Trong đó:
- n là số mol (đơn vị: mol).
- M là khối lượng mol (đơn vị: m/mol).
- m là khối lượng (đơn vị: g).
Bên cạnh đó, còn có một số công thức cũng giúp tính số mol của 1 chất. Tuỳ vào thí nghiệm và dữ kiện đề bài, các em có thể vận dụng các công thức này một cách linh hoạt. Tuy nhiên, nhìn chung những công thức tính mol này đều được suy ra từ các công thức cơ bản của hoá học lớp 8 và 9.
Ví dụ như: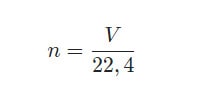
Công thức tính nồng độ phần trăm:
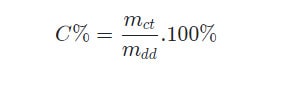
Trong đó:
- C% là nồng độ phần trăm.
- mct là khối lượng chất tan.
- mdd là khối lượng dung dịch.
- mdd = mct + mdm (mdm là khối lượng dung môi).
Công thức tính nồng độ mol:
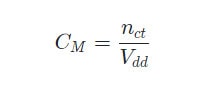
Trong đó:
- CM là nồng độ mol.
- nct là số mol chất tan.
- Vdd là thể tích của dung dịch (đơn vị: lít).
Công thức tính khối lượng:
Trong đó:
- m là khối lượng.
- n là số mol.
- M là khối lượng mol.
Tổng hợp các công thức hóa học lớp 10 theo chương
Các công thức hóa học này sẽ đi cùng các em xuyên suốt quá trình học môn hóa lớp 10 – 11 – 12. Nội dung tổng hợp công thức hóa học lớp 10 chi tiết theo từng chương dưới đây sẽ giúp các em hệ thống lại kiến thức quan trọng và ghi nhớ được lâu hơn.
Xem thêm: Các dạng bài tập hoá học lớp 10 chương trình mới
Chương 1: Nguyên tử
- Số đơn vị điện tích hạt nhân (Z) = số electron (E) = số proton (P) (Z = E= P).
- Số khối của hạt nhân (A) = số nơtron (N) + số proton (P) (A = N + P = N + Z).
Chương 2: Bảng tuần hoàn các nguyên tố hoá học và Định luật tuần hoàn
Trong chương này các em sẽ tập trung vào tính toán và ôn luyện các công thức tính số proton, electron và nơtron. Cụ thể:
- STT ô = số hiệu nguyên tử (Z) = số proton (P) = số electron (E).
- STT chu kì = số lớp electron.
- STT nhóm = số electron hóa trị.
Chương 3: Liên kết hoá học
Công thức tính khối lượng, khối lượng riêng và bán kính nguyên tử:
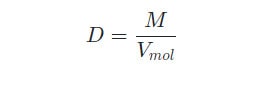
Trong đó:
- D là khối lượng riêng của nguyên tử
- Vmol là thể tích của nguyên tử.
Công thức tính thể tích của 1 nguyên tử:

Công thức tính hiệu độ âm điện và liên kết hoá học:
Gọi các hợp chất có công thức chung là: AxBy
Hiệu độ âm điện:

Chương 4: Phản ứng Oxi hoá – khử
- Định luật bảo toàn electron được biểu thị dưới công thức sau: ∑ne nhường = ∑ne nhận.
Chương 5: Nhóm halogen
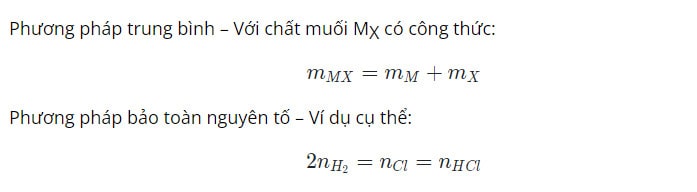
Phương pháp tăng giảm khối tượng: Phụ thuộc vào khối lượng kim loại phản ứng.
Chương 6: Oxi – Lưu huỳnh
Công thức tính khối lượng muối sunfat thu được khi hoà tan hoàn toàn hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
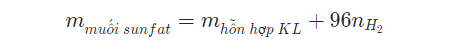
Công thức tính khối lượng muối sunfat thu được khi hoà tan hoàn toàn hỗn hợp oxit kim loại bằng H2SO4 loãng:
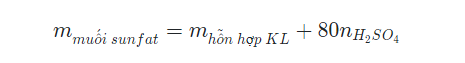
Công thức tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
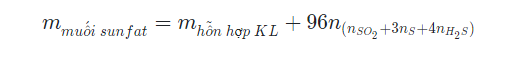
Công thức áp dụng với bài toán dẫn khí SO2 (hoặc H2S) vào dung dịch kiềm:
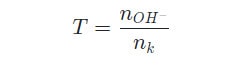
- T ≥ 2: chỉ tạo muối trung hòa.
- T ≤ 1: chỉ tạo muối axit.
- 1 < T < 2: thu được hai muối gồm muối trung hòa và muối axit.
Trong đó: m bình tăng = m chất hấp thụ
Nếu sau phản ứng có kết tủa:
- mdd tăng = m chất hấp thụ – m kết tủa
- mdd giảm = m kết tủa – m chất hấp thụ
Chương 7: Tốc độ phản ứng – Cân bằng hoá học
- Biểu thức vận tốc phản ứng:
mA + nB → pC + qD
- Biểu thức vận tốc được tính như sau:
v = k.[A]m.[B]n
Trong đó:
- k là hằng số tỉ lệ (hằng số vận tốc).
- [A], [B] là nồng độ mol chất A, B.
Các công thức hóa học lớp 10, lớp 11, lớp 12 về các hợp chất hữu cơ
Ở bậc THPT, các em sẽ gặp nhiều công thức phức tập hơn. Trong đó, các công thức liên quan các hợp chất hữu cơ luôn là “những nỗi ám ảnh muôn thuở”. Dưới đây, Tài Liệu Học Tập đã tổng hợp tất cả các công thức Hóa học lớp 10, lớp 11 và lớp 12 cần ghi nhớ giúp các em ôn tập dễ dàng.
Công thức tổng quát của este no, đơn chức, mạch hở: CnH2nO2 ( n≥2)
Số đồng phân: 2n−2
Ví dụ: Hợp chất este đơn chức no, mạch hở với công thức hóa học C2H4O2 có 2.2 − 2 = 1 đồng phân.
Công thức tổng quát của amin no, đơn chức, mạch hở: CnH2n+3N
Số đồng phân: 2n−1 (n<5)
Ví dụ: Hợp chất amin no, đơn chức mạch hở với công thức hóa học C2H7N có 2,2 − 1 = 2 đồng phân.
Công thức tổng quát của ankan: CnH2n+2
Số đồng phân: 2n−4+1
Công thức tổng quát của hidro cacbon thơm: CnH2n−6
Số đồng phân là đồng đẳng benzen: (n−6)2
Công thức tổng quát của phenol đơn chức: CnH2(n−6)O
Số đồng phân: 3n−6
Công thức tổng quát của ancol no, đơn chức: CnH2n+2O
Số đồng phân: 2n−2 (n<6)
Công thức tổng quát của andehit no, đơn chức: CnH2nO
Số đồng phân: 2n−3 (n<7)
Công thức tổng quát của axit cacboxylic no, đơn chức: CnH2nO2
Số đồng phân: 2n−3 (n<7)
Công thức tổng quát của amin đơn chức no: CnH2n+3N
Số đồng phân: 2n−1 (n<5)
Công thức tổng quát của amino axit, no (có 1 nhóm NH2 và 1 nhóm COOH): CnH(2n+1)O2N
Số đồng phân: (n!−1) (n<5)
Số đồng phân trieste tạo bởi glyxerol và hỗn hợp n axit béo:
Số trieste = n2(n+1)/2
Công thức tổng quát của xeton no, đơn chức no: CnH2nO
Số xeton: (n−2)(n−3)/2
Xem thêm: Các dạng bài tập hoá lớp 12 pdf
Các cách ghi nhớ công thức hóa học bạn nên thử
Chắc chắn ai học hóa cũng sẽ cảm thấy khó khăn trong việc ghi nhớ các công thức tính toán hay tên các nguyên tố hóa học,… Vì vậy, đã có rất nhiều phương pháp ghi nhớ hữu ích được ra đời với đầy sáng tạo. Dưới đây là 4 phương pháp đơn giản mà hiệu quả nhất các bạn có thể tham khảo.
1. Dùng những bài thơ, bài vè để nhớ
Ví dụ: Bài thơ 4 câu để nhớ các nguyên tố hóa học trong bảng tuần hoàn:
Hoàng Hôn Lặng Bóng Buổi Chiều
-H — He — Li — Be — B — C –
Nắng Oi Phía Núi Nhạt Màu Ánh Siêu
-N — O – F— Ne – Na —Mg –Al —Si-
Phong Sương Còn Ám Khói Chiều
-P—— S —– Cl — Ar —K — Ca
Sao Tinh Vân Cũng Muôn Fương Chiếu Nhoà
Sc— Ti —V — Cr— Mn—– Fe— Co —– Ni
2. Dùng cách nhớ tiếp đầu ngữ để thuộc thứ tự, tên
Trong hóa hữu cơ:
- Metan, Etan, Proban, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan.
– Các tiếp đầu ngữ trong hóa hữu cơ là: Met – Et – Prop – But – Pen – Hex – Hept – Oct – Non – Dec.
– Cách nhớ : “Mẹ em phải bón phân hoá học ở ngoài đồng” hoặc “Mắt em phai buồn phút hoàng hôn ở nơi đó.”
Nhớ dãy hoạt động hóa học của kim loại
- Dãy hoạt động hoá học của kim loại : K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au. Cách nhớ: “Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Áo Phi Âu”.
- K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au. Cách nhớ: “Khi cần nàng may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu” hoặc “Khi cả nhà may áo giáp sắt nhớ sang phố hàn đồng hiệu Á Phi Âu”.
- – Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au. Cách nhớ: “Lúc khó bà cần nàng may áo màu giáp có sắt nhớ sang phố hàn đồng hiệu Á Phi Âu”.
Nhớ các nguyên tố nhóm chính
- Nhóm IA: Li – Na – K – Rb – Cs – Fr: Lâu nay không rảnh coi phim.
- Nhóm II: Be-Mg-Ca-Sr-Ba-Ra: Bé Mang Cây Súng Bắn Ruồi
- Nhóm IIA: Be Mg Ca Sr Ba Ra: Banh Miệng, Cá, Sấu, Bẻ, Răng.
- Nhóm IIIA : B Al Ga In Ti: Bà, Anh lấy , Gà , Trong , Tủ lạnh.
- Nhóm IVA: C Si Ge Sn Pb: Chú , Sỉ , Gọi em , Sang nhậu , Phở bò.
- Nhóm VA : N P As Sb Bi: Ni cô , Phàm tục , Ắc , Sầu , Bi.
- Nhóm VIA: O S Se Te Po: Ông , Say , sỉn , té , bò.
- Nhóm VIIA : F Cl Br I At: Phải , Chi , Bé , Iêu , anh.
- Nhóm VIIIA : He Ne Ar Kr Xe Rn: Hằng , Nga , Ăn , Khúc , Xương , Rồng.
3. Thường xuyên làm đề và bài tập
Các bạn sẽ dễ dàng ghi nhớ và rèn luyện kỹ năng cũng như cải thiện tốc độ làm bài khi dùng chính tư duy của mình để làm bài tập và áp dụng kiến thức được học. Khi đó, những công thức như tính nồng độ mol, nồng độ dung dịch,… sẽ được lưu trữ vào não bộ vì được lặp lại nhiều nhờ làm bài tập. Ngoài ra, bạn học sẽ phát triển tư duy làm bài của mình và có thể dễ dàng giải các dạng bài tập mới gặp.
Xem thêm: Đề Thi Hóa THPT Quốc Gia 2022
4. Phương pháp dùng giấy note, sơ đồ tư duy, thẻ flashcard…
Sử dụng giấy note, sơ đồ tư duy, flashcard… là phương pháp học được áp dụng với hầu hết các môn học chứ không riêng môn hóa. Vì tính ứng dụng và đơn giản của nó nên được mọi người thường xuyên dùng. Khi cần phải ghi nhớ một lượng công thức hóa học lớn thì những hình ảnh mô tả và súc tích, logic sẽ giúp các bạn nhớ nhanh và hiểu bài hơn so với cách học truyền thống.
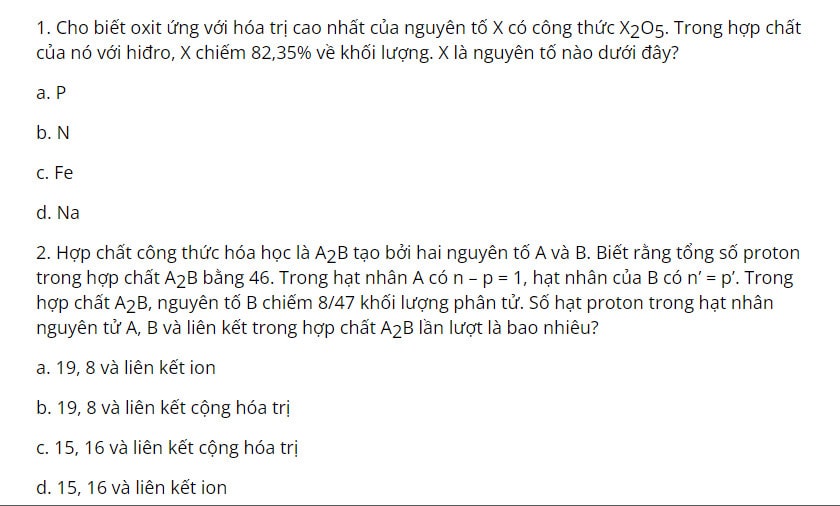
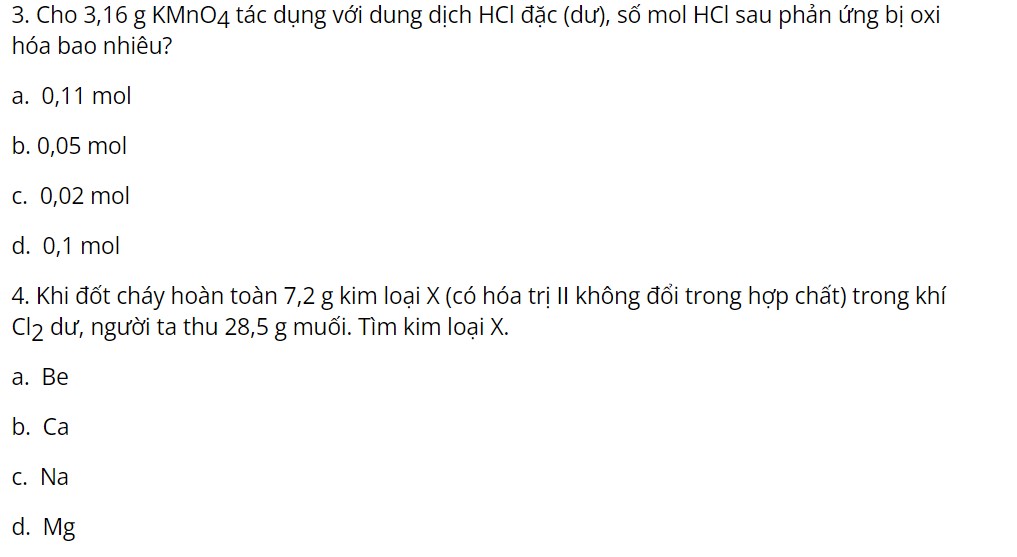
Một số bài tập vận dụng

Đáp án
Câu 1: a
Câu 2: a
Câu 3: d
Câu 4: d
Câu 5: b
Câu 6: b
Trên đây Tài Liệu Học Tập đã tổng hợp toàn bộ công thức hóa học từ lớp 12 đến lớp 12 đầy đủ chi tiết để các em học sinh có thể vận dụng và tham khảo. Hy vọng tài liệu về môn hóa học này sẽ giúp ích các em trong quá trình học tập của mình.
Tham gia group Tài Liệu Học Tập để lấy đề thi và tài liệu các bạn nhé !
Ngoài ra các em học sinh có thể tải file PDF tại đây.














Discussion about this post