– Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ sối cao hơn so với nhiều hợp chất có cùng cấu trúc phân tử nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau. Ngoài ra, nước còn là một dung môi tốt, không chỉ hoà tan được nhiều hợp chất ion, mà còn hoà tan được nhiều hợp chất có liên kết cộng hoá trị phân cực. Đặc biệt, các hợp chất có thể tạo liên kết hydrogen với nước thường tan tốt trong nước. Hầu hết các phản ứng hoá học quan trọng đối với sự sống đều diễn ra ở môi trường nước bên trong tế bào.
Hình 11.4. Liên kết hydrogen giữa alcohol và nước
Hình 11.5. Lên kết hydrogen giữa ammonia và nước
– Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng. Đó là do nước đá có cấu trúc tinh thể phân tử với bốn phân tử H2O phân bổ ở bốn định của một tử diện đểu, bên trong là cấu trúc rỗng (Hình 11.6). Điều này lý giải tại sao nước đá nổi được trên mặt nước lỏng.
Hình 11.6. Cấu trúc của tinh thể phân tử nước đá
– Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100°C).
a. Giới thiệu về tương tác van der Waals (van đơ Van)
Trong phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phần tử sẽ hình thành nên các lưỡng cực tạm thời. Ví dụ, ta có thể tìm thấy các electron phân bố như Hình 11.7 trong một phân tử.
Hình 11.7. Lưỡng cực tạm thời được hình thành do sự phân bố không đồng đều của các electron trong phân tử
– Các phân tử có lưỡng cực tạm thời cũng có thể làm các phân tử lân cận xuất hiện các lưỡng cực cảm ứng. Do đó, các phân tử có thể tập hợp thành một mạng lưới với các tương tác lưỡng cực cảm ứng , được gọi là tương tác van der Waals (Hinh 11.8).
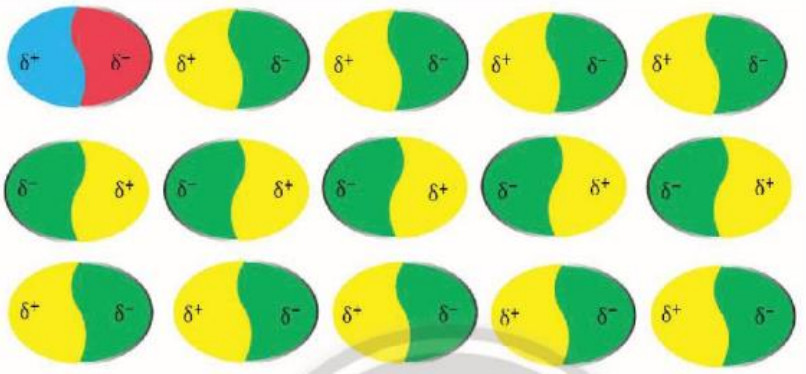
Hình 11.8. Mạng lưới tương tác lưỡng cực cảm ứng được tạo thành bởi lưỡng cực tạm thời







